DIVISIÓN EN BLOQUES
- REPRESENTATIVOS (GRUPO 1,2 Y DEL 12 AL 18)
-TRANSICIÓN (DEL 3 AL 12)
-TRANSICIÓN INTERNA (BLOQUE F)
Grupo VII-A de la Tabla Periódica
PROPIEDADES GENERALES DE LOS HALOGENO
- Son muy reactivos
-Conformado con el Hidrogeno y otros elementos
-Alto potencial de ionozación
-Alta electronegatividad
los elementos que conforman este grupo son el Flúor (F), el Cloro (Cl), Bromo (Br), Yodo (I), Ástato (At).
FLÚOR (F)
Características:
Muy toxico y reactivo
Propiedades químicas del Flúor
Reacciona con violencia con los compuestos que contienen Hidrogeno.
Ubicación
-El agua
-Amoniaco
-Sustancias organicas
Contaminación:
en las plantas provocan daños en las hojas y disminuye su crecimiento.
CLORO(Cl)
Interviene en reacciones de sustitución o de adicción tanto con materiales organicos como inorganicos.
Ubicación:
-Minas de sal
-Agua de mar
Contaminación del Cloro:
la exposición repetida a cloro en el aire puede afectar al sistema inmunitario, la sangre, el corazón y el sistema respiratorio de los animales.Dañino para animales de agua y suelo.
BROMO (Br)
Reacciona con el agua, compuestos y elemntos metalicos.Soluble en disolventes organicos e inorganicos.
Ubicación:
-Mar
Contaminación:
En las aguas superficiales afectando a los peces, langostas y algas. También en los mamiferos cuando se acumulan en los cuerpos de sus presas dañando los nervios y el ADN,aumenta las posibilidades de cancer.
YODO (I)
Propiedades químicas del Yodo
Principalmente trazador de radiactivos y ciertos procedimientos de rasioterapia.
Ubicación:
-Corteza terrestre
-Agua del mar
Contaminación:
es toxico y su vapor irrita los ojos y los pulmones
ÁSTATO
Ubicación:
-La superficie terrestre
Contaminación:
Normalmente nunca presenta riesgos.
Grupo VI-A de la Tabla Periódica
PROPIEDADES GENERALES
-el grupo del oxigeno
-telurio y polonio son metaloides
-ganan o ceden 2 electrones al formar compuestos
-O, S, Se, Te, Po, ganan o ceden dos electrones al formar compuestos.
-S, Se, Te y tal vez Po pueden enlazarse hasta con 6 átomos.
OXIGENO (O)
tiene comportamiento anómalo, al no tener orbitales D, solo puede formar dos enlaces covalentes. Se obtiene mediante destilación fraccionada del aire liquido.
Usos:
-constituye el 21° de la atmósfera terrestre
-fundamental para la vida
AZUFRE (S)
se suele encontrar en zonas volcánicas, es mal conductor del calor y no produce electricidad.
Usos:
-procesos industriales para producciónde Ácido Sulfurico
-fabricación de polvora
-vulcanizado de caucho
SELENIO (Se)
tiene aspecto metálico y se encuentra en moléculas de 8 en forma sólida, en forma de vapor y aparentemente solo hay una forma líquida.
Usos:
-electricidad y electronica
TELURIO (Te)
es un metaloide con propiedades de caracter no metalico, no es muy abundante por lo que se obtiene de la impureza de sulfatos de cobre.
Usos:
-aumentar la resistencia a la tensión en aleaciónes de cobre y plomo
-fabricacion de dispositivos termoelectricos
POLONIO (Po)

es un metaloide radioactivo muy escaso que emite radiación Alfa y Gamma, en su forma estable es altamente soluble.
Usos:
-investigación nuclear
- elimina la acumulación de cargas electrostaticas
Grupo VI-A de la Tabla Periódica
Esta formado por dos no metales, dos metaloides y un no metal (N, P, As, Sb, Bi)
Forman enlaces covalentes segundos y terceros. Tienen un alto nivel de toxicidad y se acumulan en el hígado. El N2 está en las atmósferas inertes.
Todos son sólidos a temperatura ambiente menos Nitrogeno (N) que es un gas.
Nitrogeno y Fosforo son los principales ya que tienen el nivel de electronegatividad y de ionización muy alto.
Gas diatómico se encuentra en el 78% de aire atmosférico.
No metal multivalente, tiene alta reactividad y nunca está en estado nativo.
Se da en sulfuros. El gris es normal, el amarillo es volátil y reactivo, y el negro esta entre el gris y el amarillo.
Hay amarilla, que es metaestable y hay gris, que tiene aspecto metálico y se evapora.
Es un metal, de tono blanco o plateado, cuando se pone rosado es por la oxidación.
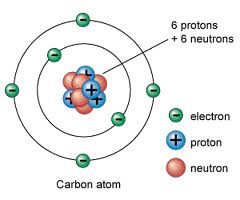
Carbono
Átomo de Carbono
- Z= 6
-La valencia covalente es 4.
-Sus enlaces son iguales en compuestos como el Metano.
-Sus ángulos de enlace son de 90° como el Fosforo.
La teoría del enlace de valencia es la que comprueba lo anteriormente dicho.
Tiene orbitales idéntico, esto es resultado de la hibridación. Dentro del Carbono se mezclan orbitales 2S con 2P.
Propiedades generales del Carbono
-Es un no metal grupo 4-A
-su símbolo es C
-su número atómico es 6
-su masa atómica es 12,017 UMAS
-su electronegatividad 2,55
-su oxidación es 4 y -4.
-es solido a temperatura ambiente
-puede formar cadenas y enlaces múltiples.
CLORO(Cl)
POLONIO (Po)

es un metaloide radioactivo muy escaso que emite radiación Alfa y Gamma, en su forma estable es altamente soluble.
Carbono
- Z= 6
-La valencia covalente es 4.
-Sus enlaces son iguales en compuestos como el Metano.
-Sus ángulos de enlace son de 90° como el Fosforo.
La teoría del enlace de valencia es la que comprueba lo anteriormente dicho.
Tiene orbitales idéntico, esto es resultado de la hibridación. Dentro del Carbono se mezclan orbitales 2S con 2P.
Propiedades generales del Carbono














No hay comentarios:
Publicar un comentario